文献解析|Nature—单细胞RNA测序首次揭秘人类胎肝造血作用(上)

成年后,骨髓产生了人体所需的血液和免疫细胞【1】。但是在胚胎生命早期,卵黄囊(YS)和肝脏在制造血液和免疫细胞中起到重要作用【1】。
此前,对造血作用过程,即血液和免疫发展过程的认识主要来源于小鼠以及体外模型。但有研究发现这一过程在老鼠和人类间存在明显差别【2,3】。
因而,有必要使用人类组织样本研究早期造血作用的分子、细胞水平结构。这不仅对认识生命早期特征十分重要,也为理解免疫缺陷等疾病提供了基础。此外,深入认识造血干细胞/多能祖细胞(HSC/MPP)的增殖对推动干细胞技术也有一定帮助。
为此,来自Newcastle大学的研究者和Cambridge大学的研究者展开合作,对7-17周人类胎肝细胞,以及皮肤、肾脏和YS细胞展开了研究。
该研究成果于2019年在《Nature》发表。
影响因子:43.070
通讯作者:Cambridge大学Wellcome Sanger研究院的Sam Behjati博士和Sarah A. Teichmann教授,血液内科系和Wellcome-MRC剑桥干细胞研究院的Elisa Laurenti博士,以及Newcastle大学Muzlifah Haniffa教授。
通讯作者实验室:Teichmann实验室
开放获取数据:原始测序数据和表达矩阵存储在ArrayExpress,编号E-MTAB-7407;代码脚本;在线交互式数据。
对于人类,胎儿骨髓在11周左右定植,20周后成为主要的造血部位【4】。为了研究发育早期血液和免疫系统的发展情况,即发育早期胎肝的造血作用,研究者使用单细胞RNA测序技术分析了近140,000个7-17周人类胎肝细胞,以及74,000个皮肤、肾脏和YS细胞,完整的构建了胎肝造血作用图谱。
同时,研究者整合了质谱流式成像,流式细胞和细胞形态学,对单细胞转录组分析结果进行补充和确认。

为了研究人类胎肝中血液和免疫细胞的发展过程,同时评估发育早期NLT(非淋巴组织)和YS(卵黄囊)中血液和免疫细胞结构,研究者首先使用荧光激活细胞分选(FACS)分离胎肝细胞(14个7-17周的样本)、皮肤(7个7-12周的样本)、肾脏(3个7-12周的样本)和YS细胞(3个4-7周的样本内)进行单细胞测序。
对单细胞测序结果进行降维聚类分析,并根据差异表达基因(DEGs)并对细胞聚群进行注释,发现:
❖ 胎肝中主要存在27个细胞聚群(图1);
❖ 不同孕龄中,这27个细胞聚群的比例不同(图1);
❖ 没有发现中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞,这与前人研究报道的粒细胞在胎儿骨髓造血作用时期出现的结果相一致【6】(图2a);
❖ 早期阶段主要是红系细胞,淋巴和髓系细胞在后期阶段出现,这与前人研究相一致【7】(图2b);
a
b
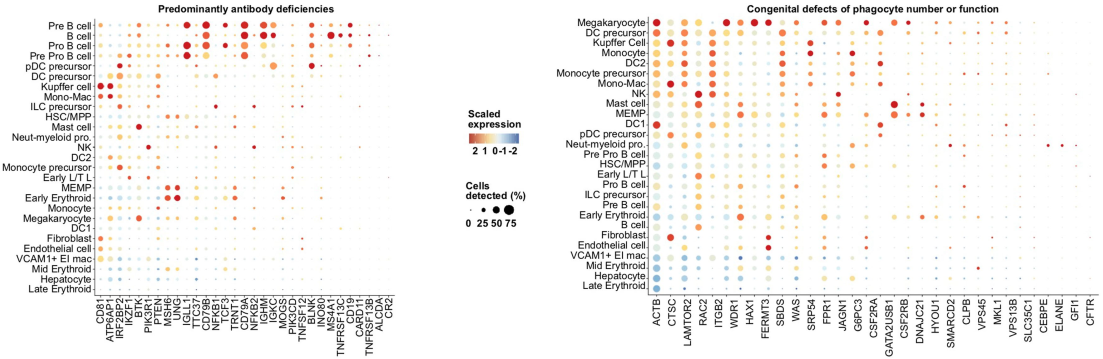
此外,研究者还提供了发育早期导致原发性免疫缺陷基因的表达水平,期望能帮助认识这些疾病的分子表型(图3显示了部分结果)。

为了确认单细胞转录组数据分析得到的细胞聚群和差异表达基因集,研究者使用随机森林分类法(Random Forest classifier)验证48个DEGs的预测能力,发现平均准确率在89%(图4)。
a
b
研究者根据编码细胞表面蛋白基因设计了FACS panel并用于分离胎肝细胞(图4a)。对这些细胞进行bulk转录测序后,基于标志基因确定了19种细胞类型(图5a)。同时,研究者也对分离得到的肝脏红细胞生成相关细胞进行了单细胞测序,确定了6种细胞类型(图5a)。此外,FACS分离的细胞形态也与红系细胞或胎儿的肥大细胞形状相一致(图5b)。
a
b
接着,研究者使用质谱流式成像评估红系细胞、肥大细胞、髓样和淋巴样细胞的空间分布,发现8-15周时肝脏结构变化显著:
❖ 虽然尚不能清晰看到中央静脉和肝门三联周围的肝小叶,但肝细胞聚集加强(图6);
❖ 血窦中出现血岛,周围聚集着肝细胞(图6);
❖ 血窦的CD68+巨噬细胞周围环绕着GYPA+型(血型糖蛋白A)红系细胞(图6);
❖ 发育早期,CD1c+ DC(树突状细胞)和B细胞系的CD79a+CD20+细胞分布稀疏(图6)。

研究者对造血作用进行进一步分析,发现(图7):
❖ 轨迹分析结果显示红系细胞-巨核细胞-肥大细胞、B细胞和先天/T淋巴细胞和髓细胞与HSC/MPP存在联系(图7a);
❖ 不同细胞谱系分化时表达发生变化的基因不同,红系细胞的TAL1和KLF1,巨核细胞系的F11R、PBX1和MEIS1,肥大细胞分化中的HES1的表达发生变化【8-11】;
❖ 比较所有造血组织,可以发现肥大细胞也存在于YS中;
❖ YS和肝脏成红血细胞表达血红蛋白基因,且随孕期发生变化,从表达HBZ和HBE1变为表达胎儿型血红蛋白亚基(HBA1和HBG2)(图7b)。
为了研究影响胎肝红细胞生成的因素,研究者预测了成红血细胞和VCAM1+巨噬细胞间特定或富集的受体-配体相互作用,结果显示VCAM1、ITGB1、ITGA4、SIGLEC1、ICAM4和SPN基因间存在显著相互作用,且这些基因编码的分子在造血作用中十分重要【12-13】(图8a)。这与免疫组化结果相一致。
图8 VCAN1+ EI巨噬细胞(紫色)和两个红系细胞群(黄色)富集的受体-配体相互作用的显著性(a),以及这些细胞VCAM1和ITGA4的表达水平小提琴图(b)。其中,EE是早期红系细胞,ME是中期红系细胞,EI是幼红细胞岛【5】。
此外,流式细胞成像分析确定VCAM1+EI巨噬细胞与成红血细胞间存在相互作用(图9),这可能解释了为什么VCAM1+EI巨噬细胞聚群与成红血细胞和巨噬细胞聚群的差异表达基因集近似(图4A)。
图9 胎肝红系细胞、VCAM1+ EI巨噬细胞、Kupffer细胞、单核-巨噬细胞及肥大细胞的成像结果【5】。
随后,研究者展开进一步分析,发现(图10):
❖ NLTs中存在巨核细胞、红系细胞、肥大细胞和MEMPs(巨核细胞-红系细胞-肥大细胞祖细胞),但是不存在HSC/MPPs(图10a);
❖ 不同样本组织中的肥大细胞、巨核细胞和红系细胞高度关联(图10a左下);
❖ 皮肤切片的免疫组化分析结果显示CD34+血管内外都有GYPA+有核细胞,与局部MEMPs分化相一致;
❖ NLT中MEMP表达MKI67及细胞周期基因,表明其具有分化能力(图10b);
❖ 皮肤MEMPs表达一些早期成红血细胞基因,意味着这些细胞可能充当了皮肤中的红系祖细胞(图10a右)。
这些结果表明发育早期,皮肤能促进红细胞生成,是胎肝以外能产生红细胞的器官。
 a
a
b
由于篇幅过长,将在下期继续介绍这篇文献。
请关注我们的下期推文哦~~~
绘真医学RedRockTM超高通量单细胞转录组测序分析,为您的研究提供有力支持!
参考文献
1.Press Office. (2019). “Cell map of liver shows blood and immune system development.” Newcastle University. https://www.ncl.ac.uk/press/articles/latest/2019/10/humancellmap/.
2.Parekh, C. & Crooks, G. M. (2013). “Critical differences in hematopoiesis and lymphoid development between humans and mice.” J. Clin. Immunol. 33, 711–715.
3.Ivanovs, A. et al. (2017). “Human haematopoietic stem cell development: from the embryo to the dish.” Development 144, 2323–2337.
4.Holt, P. G. & Jones, C. A. (2000). “The development of the immune system during pregnancy and early life.” Allergy 55, 688–697.
5.Popescu, D., et al. (2019). “Decoding human fetal liver haematopoiesis.” Nature 574, 365–371.
6.Ohls, R. K. et al. (1995). “Neutrophil pool sizes and granulocyte colony-stimulating factor production in human mid-trimester fetuses.” Pediatr. Res. 37, 806–811.
7.Kashem, S. W., Haniffa, M. & Kaplan, D. H. (2017). “Antigen-presenting cells in the skin.” Annu. Rev. Immunol. 35, 469–499.
8.An, X. et al. (2014). “Global transcriptome analyses of human and murine terminal erythroid differentiation.” Blood 123, 3466–3477.
9.Gautier, E.-F. et al. (2016). “Comprehensive proteomic analysis of human erythropoiesis.” Cell Rep. 16, 1470–1484.
10.Dedhia, P., Kambayashi, T. & Pear, W. S. (2008). “Notch2 paves the way to mast cells by Hes1 and Gata3.” Proc. Natl Acad. Sci. USA 105, 7629–7630.
11.Okada, Y. et al. (2003). “Homeodomain proteins MEIS1 and PBXs regulate the lineage-specific transcription of the platelet factor 4 gene.” Blood 101, 4748–4756.
12.Klei, T. R. L., et al. (2017). “From the cradle to the grave: the role of macrophages in erythropoiesis and erythrophagocytosis.” Front. Immunol. 8, 73.
13.Kessel, K. U. et al. (2017). “Emergence of CD43-expressing hematopoietic progenitors from human induced pluripotent stem cells.” Transfus. Med. Hemother. 44, 143–150.
更多信息请关注我们的网站
www.geno-truth.com/singlecell
联系电话:4000-672-118
服务邮箱:service@geno-truth.com
●文献解析|Science—scRNA-seq揭示水螅再生机制






