快讯|FDA批准三阴性乳腺癌(TNBC)首款抗体偶联药物Sacituzumab Govitecan
FDA加速批准了抗体药物偶联物(ADC)sacituzumab govitecan-hziy(Trodelvy)用于既往接受过至少两种疗法的转移性三阴性乳腺癌(TNBC)患者。[1]
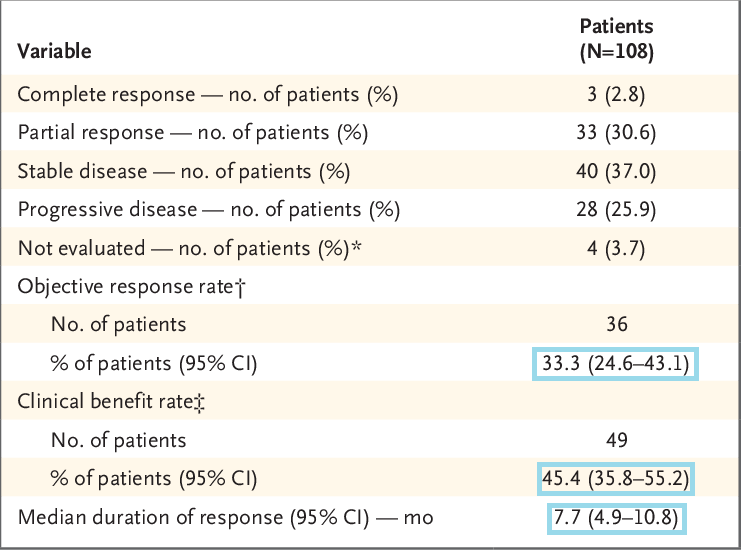
这项批准基于TNBC的1/2期sacituzumab govitecan研究结果,在中位随访9.7个月时,据评估客观缓解率(ORR)为33.3%(95%CI ,24.6%-43.1%),中位缓解持续时间(DOR)为7.7个月(95%CI,4.9-10.8)。[2]临床获益率(ORR+疾病稳定率)为45.4%。独立盲法中心评估ORR为34.3%(95%CI,25.4%-44.0%),中位DOR为9.1个月(95 CI,4.6-11.3)。
“这是首个专门针对转移性TNBC(一种预后较差且有效疗法很少的侵袭性癌症)的ADC,Trodelvy的获批将为临床医生提供治疗该疾病的新方法。” 马萨诸塞州综合医院癌症中心乳腺癌精准医疗主任、2期试验首席研究员Aditya Bardia博士在新闻稿中表示。“在我们的试验中,Trodelvy在难治性转移性TNBC患者中证明了其具有临床意义,并为转移性乳腺癌患者带来了更好的疗效。”

Sacituzumab govitecan由伊立替康(irinotecan)的活性代谢物SN-38与靶向TROP-2的人源化IgG抗体偶联而成,TROP-2是一种在90%以上的TNBC中表达的细胞表面糖蛋白。
1/2期临床试验包括108位TNBC患者,中位年龄为55岁(范围31-80)。大多数患者内脏转移(80%)。在每28天一周期的第1天和第8天,以10 mg / kg的剂量给予Sacituzumab govitecan治疗。
预先治疗方案的中位数为3(范围2-10),其中有16.7%使用检查点抑制剂。此外,有41%的患者接受三线治疗,有59%的患者接受四线或后续治疗。最常见的预先疗法是紫杉烷类药物(98%),蒽环类药物(86%),环磷酰胺(85%)和铂类药物(75%)。
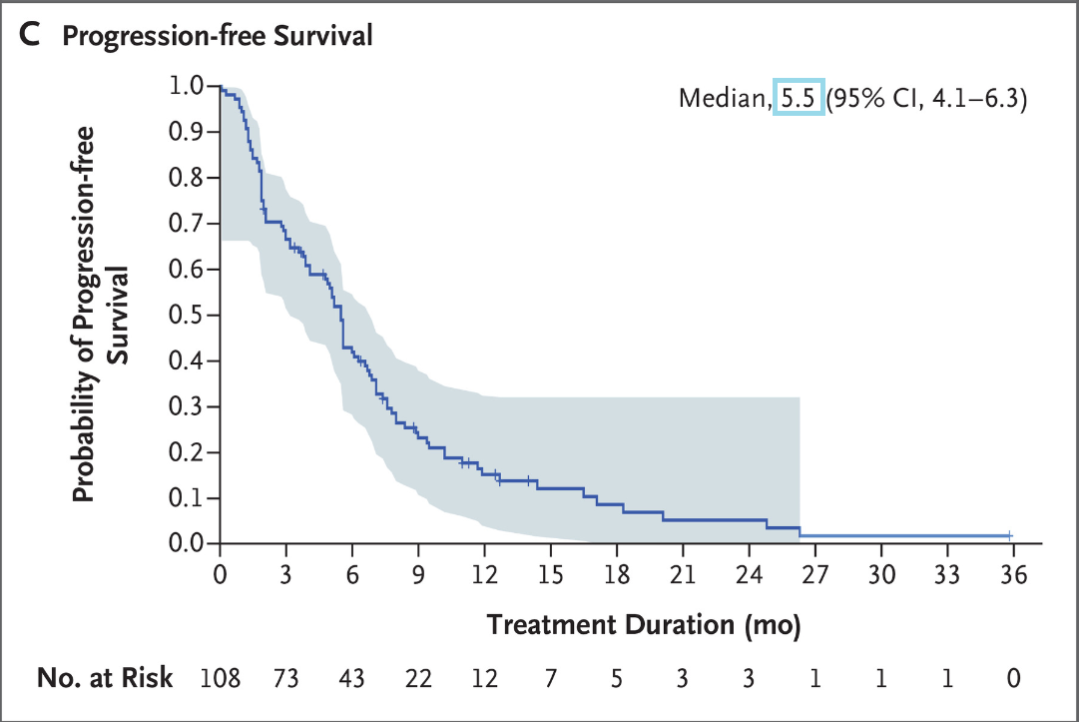
中位无进展生存期(PFS)为5.5个月(95%CI,4.1-6.3)。预估6个月PFS率为41.9%,sacituzumab govitecan治疗的12个月PFS率预估为15.1%。中位总生存期(OS)为13.0个月(95%CI,11.2-13.7),预估6个月OS率为78.5%,预估12个月OS率为51.3%。
接受sacituzumab govitecan治疗的患者中有85%发生了3/4级不良反应(AEs)。据报道,有35%的患者发生严重AEs。总体而言,仅3例患者因AEs停药,其中2例被认为与研究药物相关。25%的患者剂量降低至7.5 mg / kg,其余患者能够以10 mg / kg的剂量继续使用。
最常见的(≥10%)3/4级AE是中性粒细胞减少症(41.7%),贫血(11%),白细胞减少(11%),低磷血症(9%),腹泻(8%),疲劳乏力(8%)。在研究过程中,有10例患者(9.3%)出现了发热性中性粒细胞减少。此外,治疗期间有4例死亡,3例因AEs停药。

Sacituzumab govitecan的加速批准取决于III期ASCENT研究验证性试验的结果。Sacituzumab govitecan的开发商Immunomedics最近宣布,由于“令人信服的疗效证据”,III期ASCENT研究探索sacituzumab govitecan用于转移性TNBC患者治疗的研究已经提前终止。[3]该公司根据独立数据安全监察委员会的一致建议提前中止了试验。
“我们很自豪将Trodelvy引入急需新治疗选择的转移性TNBC患者中。Trodelvy有潜力成为TNBC疾病管理中的标准疗法,我们急切地等待着其他亚型转移性乳腺癌研究的结果,” Immunomedics首席医学官Loretta M. Itri医生表示。“这项批准凸显了我们独特的ADC平台的潜力,并强化了在许多实体瘤治疗中靶向TROP-2抗原的重要性。我们致力于扩大Trodelvy的潜在应用于其他Trop-2表达的癌症中,特别是那些未满足治疗需求的癌症。”
参考文献:
1、FDA Grants Accelerated Approval for Immunomedics’ Trodelvy in Previously-Treated Metastatic Triple-Negative Breast Cancer. Published April 22, 2020. https://yhoo.it/3eCev8R. Accessed April 22, 2020.
2、Immunomedics Announces ASCENT Study to be Stopped for Compelling Efficacy. Published April 6, 2020. https://bit.ly/2RgJ3mu. Accessed April 6, 2020.
3、Bardia A, Mayer IA, Vahdat LT, et al. Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer. N Eng J Med. 2019;380:741-751. doi: 10.1056/NEJMoa1814213






