DNA不断受到潜在的破坏性攻击,需要一个复杂的检测和修复的分子信号通路来维持基因组的完整性。DNA同源重组修复(Homologous Recombination Repair,HRR)是DNA缺陷修复的主要机制之一,已成为一个真正的治疗靶点。

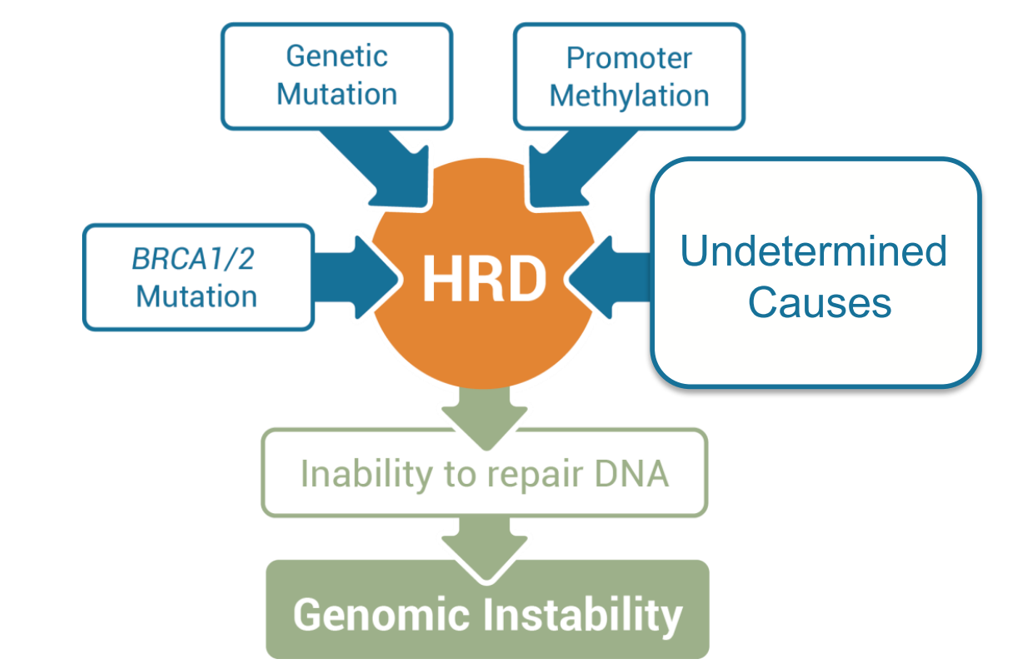
靶向HRR活性的基本原理是肿瘤中DNA同源重组修复缺陷(Homologous Recombination Deficiency, HRD)的频繁发生。HRD的发生与许多机制相关,包括基因突变,启动子甲基化,以及其他尚未定义/发现的原因。
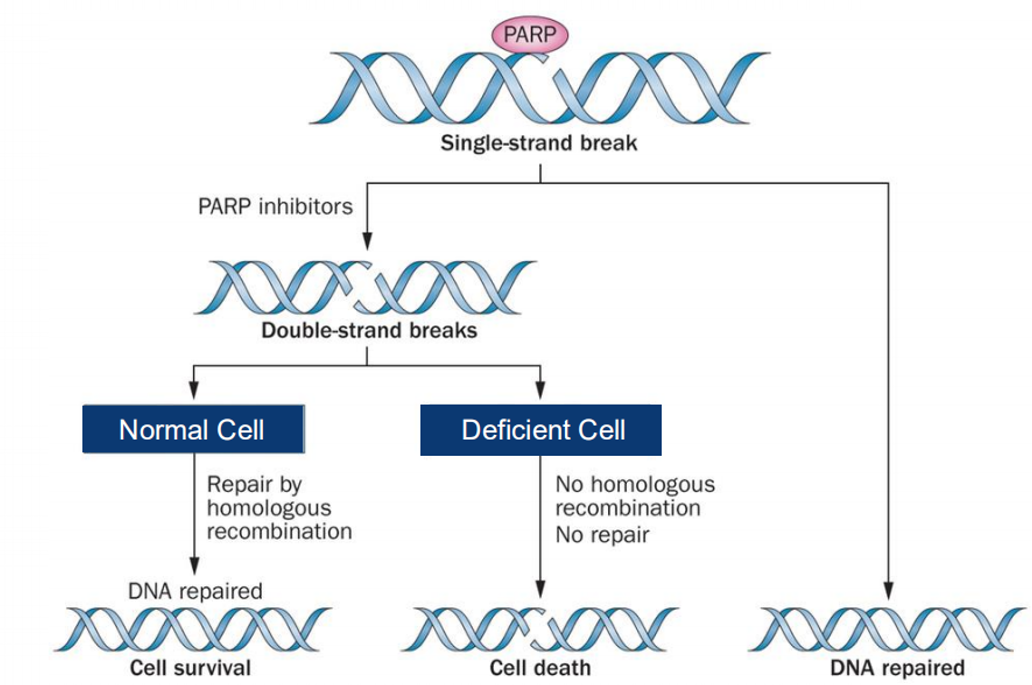
聚ADP核糖聚合酶(PARP)是一种通过碱基切除修复途径修复单链断裂的酶,而PARP抑制剂(PARPi)的作用机理是基于DNA修复损伤机制,通过抑制DNA修复蛋白结合,并使PARP从DNA缺口处解离,阻断后续的单链DNA修复过程。因此,在肿瘤细胞内,如果PARP功能被抑制就会导致DNA单链断裂的积累,进而会导致DNA双链断裂。而此时如果肿瘤细胞存在HRD,就无法进行同源重组修复,从而导致肿瘤细胞死亡。
PARP抑制剂是第一种成功利用合成致死概念获得批准在临床使用的抗癌药物。迄今为止,FDA批准的PARP抑制剂共四种,分别是:1、奥拉帕利(Olaparib,Lynparza)用于卵巢癌/输卵管癌/腹膜癌(以下简称卵巢癌)、乳腺癌、胰腺癌和转移性去势抵抗性前列腺癌(mCRPC);2、芦卡帕利(Rucaparib、Rubraca)用于卵巢癌和mCRPC;3、尼拉帕利(Niraparib,Zejula)用于卵巢癌;4、他拉唑帕利(Talazoparib,Talzenna)用于乳腺癌;

具体FDA获批时间和适应症如下表所示:

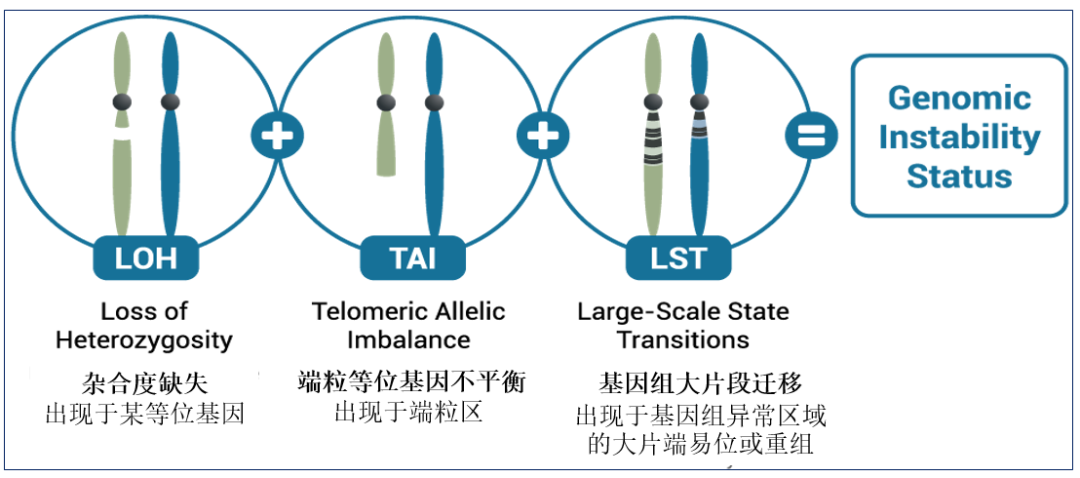
对于HRD 检测及 HRD 评分,目前国内尚无统一标准,主要包括两种途径:1、HRR Gene Panel:通过检测关键HRR基因突变来评估产生HRD的原因。2、HRD Genomic Scar:通过检测基因组损伤的模式来鉴定HRD的结果。目前国际报道的卵巢癌PARP抑制剂治疗的相关研究主要选择使用HRD Genomic Scar法鉴定HRD,基本原理是基于HRD将以一种特定且可识别的方式标记(或损伤)基因组,造成基因组的不稳定性。检测方法是通过NGS测序,分析肿瘤细胞内的单核苷酸多态性(singlenucleotidepolymorphisms,SNP)位点,从而计算基因组不稳定状态的评分,这些指标包括:杂合性缺失(LOH)、端粒等位基因不平衡(TAI)和大片段迁移(LST)。
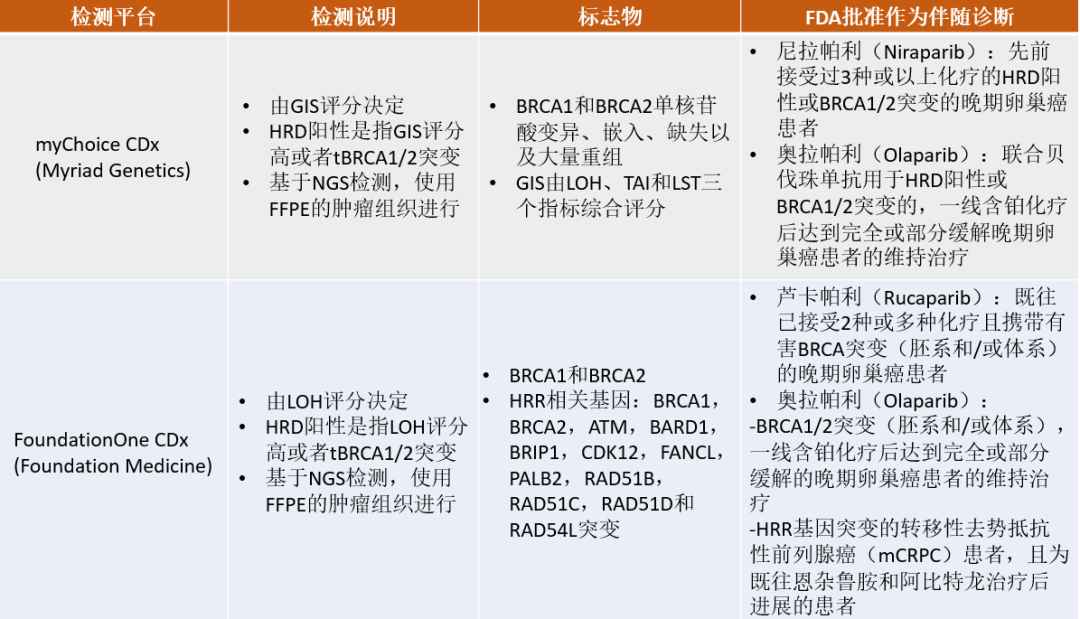
其中FDA批准了2种HRD检测平台作为辅助诊断工具:Foundation Medicine's LOH检测平台和MyriadGenetics myChoice® HRD检测平台。具体如下表所示:
注:
GIS:基因组不稳定评分;FFPE:福尔马林固定石蜡包埋;
GIS评分:
1、并非直接检测HRR通路的相关基因,而是评估HRD造成的后果,并进行综合评分:
杂合性缺失(LOH)
端粒等位基因不平衡(TAI)
大片段迁移(LST)
2、HRD与否由综合评分决定:
综合评分≥42 : HRD
综合评分<42 : HRR
尽管HRD检测已明确确定对于卵巢癌和前列腺癌患者可从PARP抑制中获得显著益处,但HRD做为预测性生物标志物的有效性尚需要进一步的探索研究。目前的检测仍然漏掉了许多潜在的应答者,部分HRD阴性的乳腺癌患者也能从PARP抑制中获得益处,这就使得研究者们不得不考虑PARP抑制剂是否适合所有卵巢癌患者。许多评估PARP抑制剂作为单一疗法和与其他药物联合治疗HRD阳性患者的临床试验正在进行中。一些基于样本为血液的HRD检测也正在探索中。我司绘真医学可提供同源重组修复缺陷HRD评估,帮助患者预测奥拉帕利、尼拉帕利、卢卡帕利、Talazoparib等PARP抑制剂药物疗效,制定个体化治疗方案。

参考文献:
1.https://www.onclive.com/view/parp-inhibitor-therapy-options-are-transforming-landscape-in-ovarian-cancer2.https://www.onclive.com/view/hrd-testing-heralds-a-new-biomarker-but-questions-linger3.Pujade-Lauraine E, Ledermann JA, Selle F, et al; SOLO2/ENGOT-Ov21 Investigators. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation: a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(9):1274-1284.doi:10.1016/S1470-2045(17)30469-24.Moore K, Colombo N, Scambia G, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med. 2018;379(26):2495-2505. doi:10.1056/NEJMoa18108585.Ray-Coquard I, Pautier P, Pignata S, et al; PAOLA-1 Investigators. Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. N Engl J Med. 2019;381(25):2416-2428. doi:10.1056/NEJMoa1911361
6.Poveda A, Floquet A, Ledermann JA, et al. Final overall survival (OS) results from SOLO2/ENGOT-ov21: a phase III trial assessing maintenance olaparib in patients (pts) with platinum-sensitive, relapsed ovarian cancer and a BRCA mutation. J Clin Oncol. 2020;38(suppl 15):6002. doi:10.1200/JCO.2020.38.15_suppl.60027.Swisher EM, Lin KK, Oza AM, et al. Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 part 1): an international, multicentere, open-label, phase 2 trial. Lancet Oncol. 2017;18(1):75-87. doi:10.1016/S1470-2045(16)30559-98.Coleman RL, Oza AM, Lorusso D, et al; ARIEL 3 Investigators. Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;390(10106):1949-1961. doi:10.1016/S0140-6736(17)32440-6