八种非小细胞肺癌ROS1靶向药物大盘点!
在过去的20年中,非小细胞肺癌(NSCLC)的治疗在不断变革。已经发现三分之二的患者携带分子驱动因素,并且目前越来越多的患者使用FDA批准的药物作为靶向治疗药物。其中分子驱动因素ROS1阳性肿瘤(ROS1重排)虽然罕见,但ROS1和间变性淋巴瘤激酶(ALK)之间存在同源性、ROS1和ALK阳性NSCLC之间存在相似性,因此ALK抑制剂被重新用于治疗ROS1阳性疾病。
2016年已获批ALK融合治疗的克唑替尼(crizotinib,Xalkori)成为首个专门针对ROS1阳性NSCLC患者的药物。同时,新兴的临床试验设计促进了2019年恩曲替尼(entrectinib,Rozlytrek)针对ROS1阳性疾病的后续批准。
疾病进展至中枢神经系统(CNS)对于NSCLC患者而言是一大挑战。克唑替尼的疗效受限,因为它无法有效穿越血脑屏障保护层(BBB)。尽管恩曲替尼具有更好的CNS活性,但它面临第二大主要障碍:ROS1耐药突变的发展。
为了努力解决这两个关键问题,开发了下一代ROS1抑制剂,旨在提高CNS的渗透性并抵抗广谱ROS1耐药突变的活性。
劳拉替尼(lorlatinib,Lorbrena)的开发是为了应对ALK阳性NSCLC 中的挑战,并且已获批。最近公布的1/2期试验结果表明,它可能很快将加入到ROS1阳性疾病的治疗中。
较新的药物洛普替尼(repotrectinib,TPX-0005)和taletrectinib(曾用名DS-6051b)更好地解决了ROS1耐药机制,并已显示出对最常见的ROS1耐药突变(G2032R)的初步活性。在进行中的TRIDENT-1研究中(NCT03093116),洛普替尼证实了在3名未接受过酪氨酸激酶抑制剂(TKI)治疗的CNS疾病患者中观察到有希望的颅内缓解率(IC-ORR)为100%。后续2期研究的结果可能有助于确定洛普替尼是否对CNS进展及克唑替尼耐药有响应。
针对ROS1阳性 肿瘤、主要为NSCLC患者、包含FDA批准药物及新药的TKIs临床开发试验正在进行中。
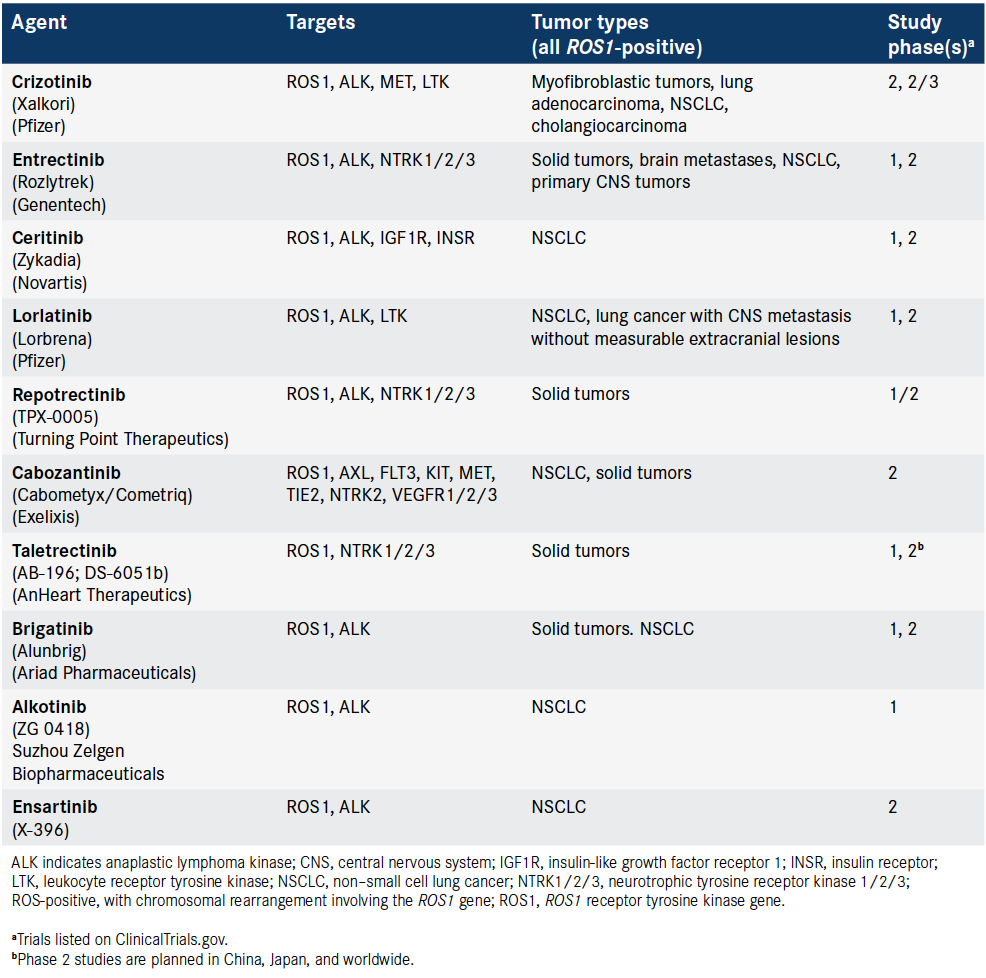 信息来源:ClinicalTrials.gov
信息来源:ClinicalTrials.gov
与ALK相似的罕见驱动基因ROS1
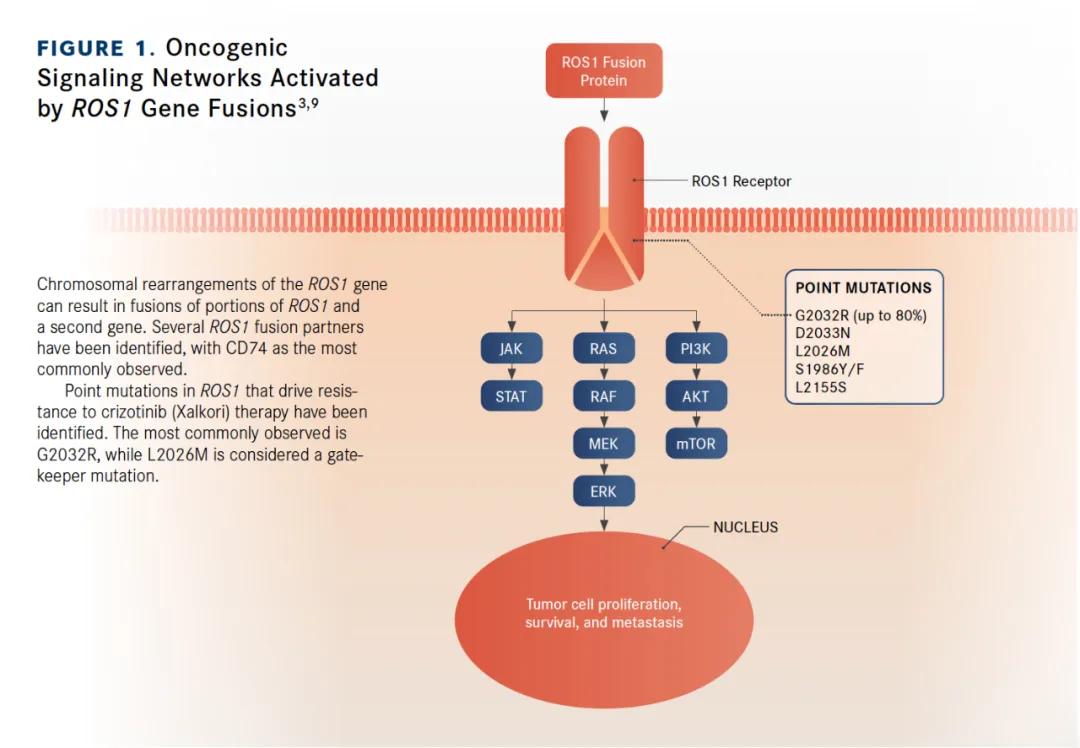
ROS1位于6q22染色体,基因编码受体酪氨酸激酶样孤儿受体。ROS1蛋白的生理功能知之甚少,它存在于多种胚胎组织和器官中,但在成年人中表达受限。ROS1是胰岛素受体家族中其自身亚家族的唯一成员,并且与该家族中的另一激酶ALK密切相关。
ROS1活性在体外驱动癌变的能力是在20世纪80年代被发现的,当时发现它是鸟肉瘤病毒的致癌基因产物。然而,直到2003年,涉及ROS1基因的染色体重排才与人类癌症的发展相关联。
值得注意的是,在NSCLC患者中发现的ROS1基因融合,最常见的是CD74-ROS1融合。总体而言,ROS1融合很少见,在腺癌组织学中,融合频率高达约3%,在非腺癌组织中,融合频率不到1%。
在这些基因融合中激活ROS1的确切机制尚不完全清楚。产生的融合蛋白具有基本的ROS1激酶活性,激活了下游信号通路,包括MAPK,PI3K / AKT和JAK通路,进而引起肿瘤的发生(图1)。
在2007年的同一里程碑研究中NSCLC发生的ROS1和ALK基因融合首次得到描述。ROS1与ALK具有显著的序列同源性。ROS1和ALK阳性的NSCLC也具有相似的临床特征:患者通常年轻,轻度吸烟或从不吸烟,并且具有腺癌组织学特征。
克唑替尼开辟新天地
ALK抑制剂的成功开发已将基因融合定位为NSCLC中一类重要的可控的驱动变异。由于2种蛋白质之间的同源性,目前大多数可用的ALK抑制剂也靶向ROS1。克唑替尼最初被开发为MET激酶抑制剂,但随后被发现是ALK和ROS1的有效抑制剂。
2011年FDA批准克唑替尼用于ALK阳性NSCLC的治疗。第二年,随着克唑替尼在ROS1阳性NSCLC中发现疗效,对正在进行的PROFILE 1001 1期克唑替尼治疗晚期ALK重排的NSCLC临床试验进行了修正,扩大了ROS1融合患者队列(NCT00585195)。
在PROFILE 1001扩展队列中,克唑替尼的客观缓解率(ORR)为72%,中位无进展生存期(PFS)为19.2个月。基于这些结果,克唑替尼于2016年获得FDA批准用于治疗ROS1阳性NSCLC。在中位随访62.6个月后, PROFILE 1001的最新数据发现,中位总生存期(OS)为51.4个月。[1]

尽管起初有缓解,但大多数接受克唑替尼治疗的患者最终仍会进展,回顾性研究表明,许多患者进展为脑转移瘤或既往颅内疾病进展。克唑替尼不能很好地穿透BBB保护层,这被认为是限制NSCLC患者疗效的一个因素,在这些患者中,CNS进展常见。
在ALK阳性NSCLC中,标准疗法是二代ALK抑制剂之后用克唑替尼,并且已经对ROS1融合患者采取了相同的方法。像克唑替尼一样,恩曲替尼也是ATP竞争性ROS1抑制剂。它还靶向ALK和NTRK1/2/3。在临床前试验中,恩曲替尼展示了穿透BBB的能力,与克唑替尼相比,它可以更好的控制颅内疾病。
扩大一线治疗标准
1恩曲替尼
恩曲替尼的开发体现了创新的临床试验方法,旨在更有效地驱动罕见变异(例如ROS1)。该药物是在2期临床试验中评估的,该试验根据特定的分子变异而非肿瘤组织学招募了患者。
迄今为止,恩曲替尼在预先接受过ALK或ROS1抑制剂治疗的患者中尚未显示活性。相比之下,在3项临床试验(2项1期试验和2期篮子试验)中,对恩曲替尼治疗的53例未接受过TKI的 ROS1阳性NSCLC 患者进行的综合疗效分析显示,ORR为77%,中位PFS为19个月。
在基线时有23例CNS转移的患者中,ORR为74%,中位PFS为13.6个月;20例无CNS疾病的患者ORR为80%,中位PFS为26.3个月。患CNS疾病亚组的IC-ORR为55%,中位颅内缓解持续时间(DOR)为12.9个月。在134位接受安全性评估的患者中(包括未接受过TKI的患者),最常见的与治疗相关的不良反应(TRAE)包括消化不良,头晕,便秘,腹泻,体重增加,疲劳麻木和恶心。多数是一级或二级;不太常见的严重AE可通过改变剂量进行治疗。
根据这些数据,恩曲替尼于2019年8月获得监管部门批准用于治疗ROS1阳性NSCLC。由于ROS1融合的罕见性,在随机3期临床试验中克唑替尼或恩曲替尼与化疗相比具有挑战性,但前瞻性临床试验和回顾性分析强烈表明ROS1 TKIs在一线治疗中的优越性,已成为标准疗法。
目前尚不清楚最佳TKI的选择,但是恩曲替尼CNS渗透率的提高证明其优越性。3期随机试验不太可能将克唑替尼和恩曲替尼比较,因为ROS1重排的NSCLC患者人数很少,由于试验设计的差异,也很难与临床试验数据进行直接比较。但是,最近一项创新的“虚拟临床试验”的结果提供了一些见解。
根据2019年美国临床肿瘤学会上发表的研究结果,研究人员搜索了一个大型数据库,并发现了用克唑替尼(n = 69)治疗的ROS1阳性NSCLC身份不明的电子患者记录,这些患者符合3项已发布的恩曲替尼试验入组要求(n = 53)。尽管这种方法存在挑战,但比较结果显示,经恩曲替尼治疗的患者停药时间更长,PFS延长。
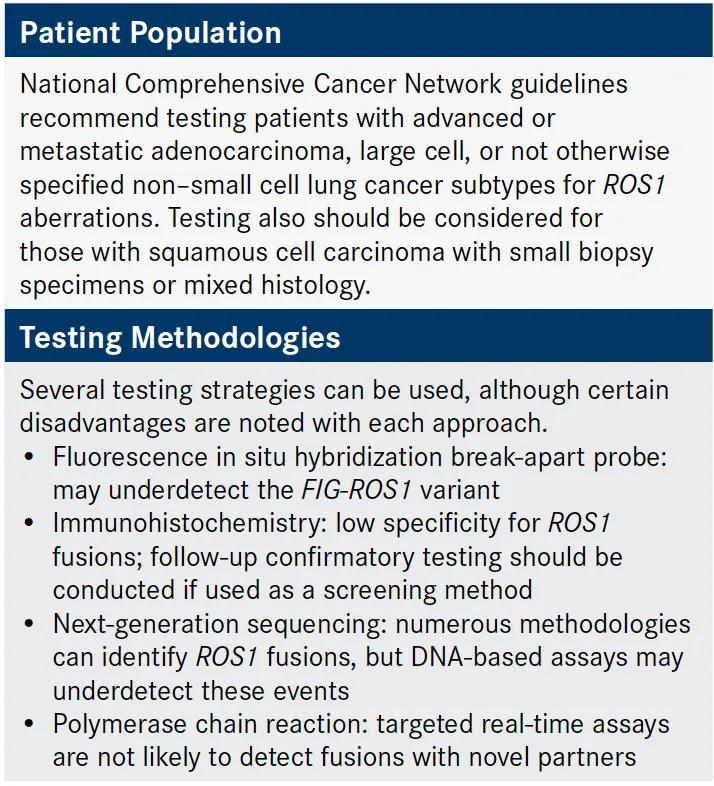
许多专业指南建议对晚期肺腺癌患者进行ROS1融合检测。免疫组织化学,荧光原位杂交和下一代测序均可用于识别ROS1重排,每种都有其自身的优点和局限性(图2)。
2色瑞替尼
另一种具有改善BBB穿透性的口服ATP竞争性ROS1抑制剂是色瑞替尼(ceritinib,Zykadia)。该药物也是ALK抑制剂,已被批准用于治疗TKI初治和克唑替尼耐药的ALK阳性NSCLC。在一项临床试验(NCT01283516)中,色瑞替尼在克唑替尼敏感和耐药的ALK阳性NSCLC患者中均表现出活性。
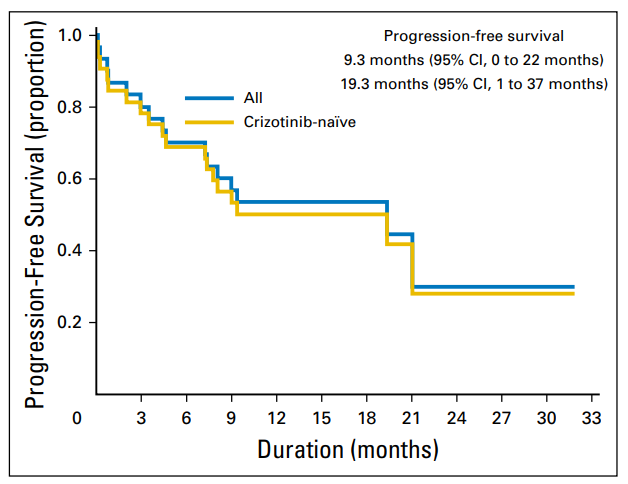
2期色瑞替尼临床试验(NCT01964157)中30例未经色瑞替尼治疗的ROS1阳性NSCLC患者,ORR为67%,中位PFS为19.3个月,与克唑替尼和恩曲替尼的2期试验结果相似。[2]在8例CNS疾病患者中,IC-ORR为25%,颅内疾病控制率(DCR)为63%。不幸的是,预先使用过克唑替尼治疗的2例患者均无响应。色瑞替尼目前尚未被FDA批准用于ROS1阳性NSCLC 患者,但将来可能会成为另一种一线治疗选择。
耐药性挑战
尽管恩曲替尼和色瑞替尼的临床试验仅包括有限的患者数,但这些研究结果表明,两种药物对克唑替尼耐药的患者均无活性,表明对CNS渗透率更高的药物需求。另外,缺乏响应也突出了ROS1抑制剂临床疗效的另一重大挑战:耐药性的发展。
与ALK阳性NSCLC的研究结果相似,已发现ROS1的点突变可驱动ROS1阳性患者对克唑替尼的耐药性。一项回顾性研究发现约50%的克唑替尼耐药肿瘤中存在ROS1突变。迄今为止确定的包括“看门突变”(L2026M),会影响几种溶剂前沿突变。
溶剂前沿突变特别顽强,包括最常见的ROS1抗性突变G2032R。目前大多数可用的ROS1抑制剂都具有一个额外的化学基团,该基团延伸到溶剂前沿,即激酶结构域的外部,而导致该区域氨基酸置换的突变会阻碍ROS1抑制剂的结合。
尽管未经直接测试,但由于恩曲替尼对类似ALK突变的活性较差,因此预计不会对G2032R突变有效。
1劳拉替尼
劳拉替尼是批准用于二线或三线ALK阳性NSCLC 治疗的下一代ROS1和ALK抑制剂。已证明其具有穿越BBB的能力,并且在临床前研究中,它抑制携带L2026M和G2032R ROS1突变的细胞。
在最近的1/2期临床试验(NCT01970865)中,有69例ROS1阳性的NSCLC患者接受劳拉替尼治疗;其中初次使用TKI的有21例,预先接受过克唑替尼治疗的有40例,预先接受过另一种ROS1 TKI或2种及以上的ROS1 TKIs治疗的有8例。客观缓解率分别为62%,35%和13%,中位DOR为25.3个月,13.8个月和5.6个月。[3]
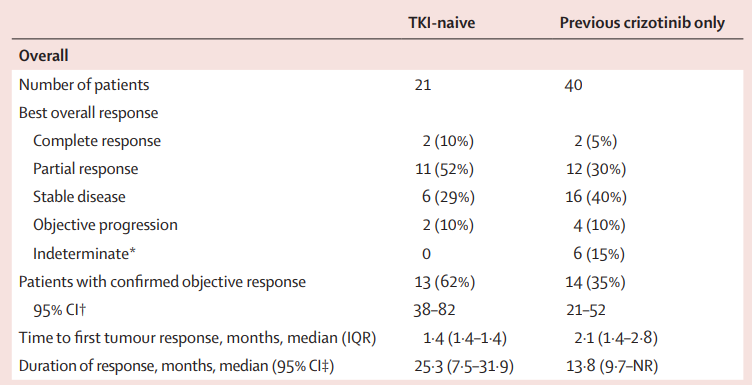
一例携带K1991E突变的患者和1例携带S1986F突变的患者均产生了部分缓解(PR)。然而,尽管有4名患者出现了肿瘤缩小,但6例携带ROS1 G2032R突变的患者最佳的缓解状态是疾病稳定(SD)。64%的TKI初治患者和50%的克唑替尼耐药的CNS转移患者颅内缓解。
劳拉替尼一般耐受良好。43%的患者发生3或4级TRAEs,其中最常见的是高甘油三酯血症(19%)和高胆固醇血症(14%)。在7%的患者中观察到严重TRAEs。
2布加替尼
布加替尼(Brigatinib,Alunbrig)是另一种经FDA批准用于ALK阳性NSCLC 二线治疗的ALK抑制剂,对许多克唑替尼耐药相关的ALK突变具有活性。在一项针对晚期恶性肿瘤患者的1/2期研究中,有3例ROS1阳性NSCLC 患者,其中有2例(其中1例预先接受过克唑替尼治疗)发生客观缓解。
3卡博替尼
卡博替尼(Cabozantinib)的独特之处在于它最初并未设计为ALK或ROS1抑制剂,尽管它的许多靶标包含后者。这种多靶点激酶抑制剂由于抑制VEGF和MET通路而具有抗血管生成特性。它被批准用于治疗甲状腺髓样癌患者(以Cometriq商品名销售)和晚期肾和肝细胞癌患者(以Cabometyx商品名销售)。
临床前研究表明,卡博替尼可有效抑制具有几种ROS1溶剂前沿突变(包括G2032R)的细胞系生长,最近的病例报告表明,对克唑替尼和色瑞替尼耐药的ROS1阳性NSCLC 患者具有活性。
下一代靶药
1Taletrectinib
两种更新的ROS1抑制剂最近在1期临床试验中对克唑替尼耐药患者显示出希望。Taletrectinib由第一三共株式会社先前开发为DS-6051b;在2018年末,该药被授权给葆元医药。最近有报道称,该公司已获中国药品评估中心的批准,开始进行2期试验,并且还计划在日本和世界其他地区(包括美国)启动2期试验。
Taletrectinib是ROS1和NTRK1/2/3双重抑制剂。它在体外和体内均能显著抑制G2032R突变型癌症的发展,并在临床前模型中显示对携带G2032R突变的克唑替尼耐药的ROS1阳性癌症有效。在晚期实体瘤患者中进行的一项首次人体研究包括6例ROS1阳性NSCLC 患者,这些患者预先接受过克唑替尼治疗,并且可评估其响应。这些患者中有2例PR,2例SD。
2洛普替尼
Turning Point Therapeutics公司开发了洛普替尼,它是ROS1,ALK和NTRK1/2/3抑制剂,专门用于克服溶剂前沿突变。它被设计为具有更好的CNS类药物特性,并改善了BBB渗透性。在临床前模型中,洛普替尼具有针对ROS1 G2032R和D2033N溶剂前沿突变的有效活性。
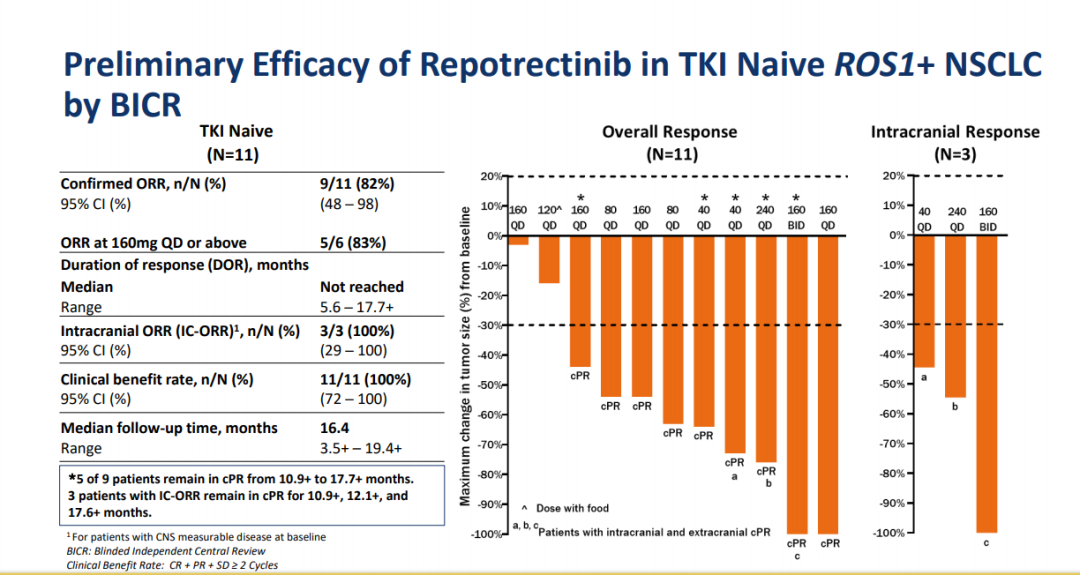
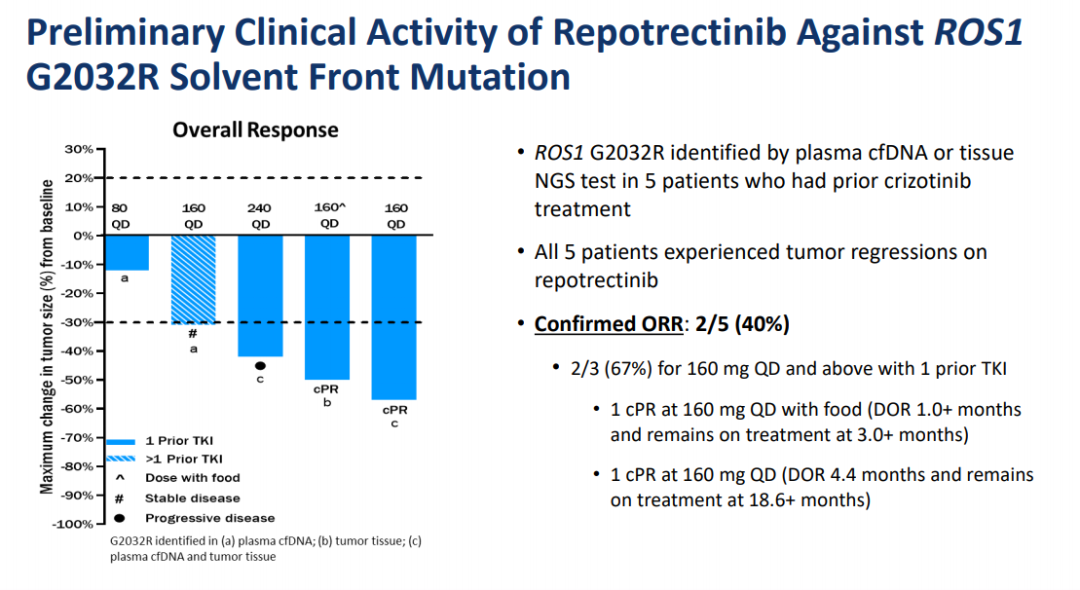
最近进行中的TRIDENT-1试验(NCT03093116)报告了1期结果。在该试验中,有33例ROS1阳性的NSCLC患者,其中包括18名CNS转移患者,接受了逐渐增加剂量的洛普替尼(每日一次40 mg至每日两次200 mg)。11例TKI初治患者的ORR为82%,IC-ORR为100%;预先接受过1次TKI治疗的患者ORR为39%(7/18),IC-ORR为75%(3/4);5名G2032R突变患者,ORR为40%。[4]

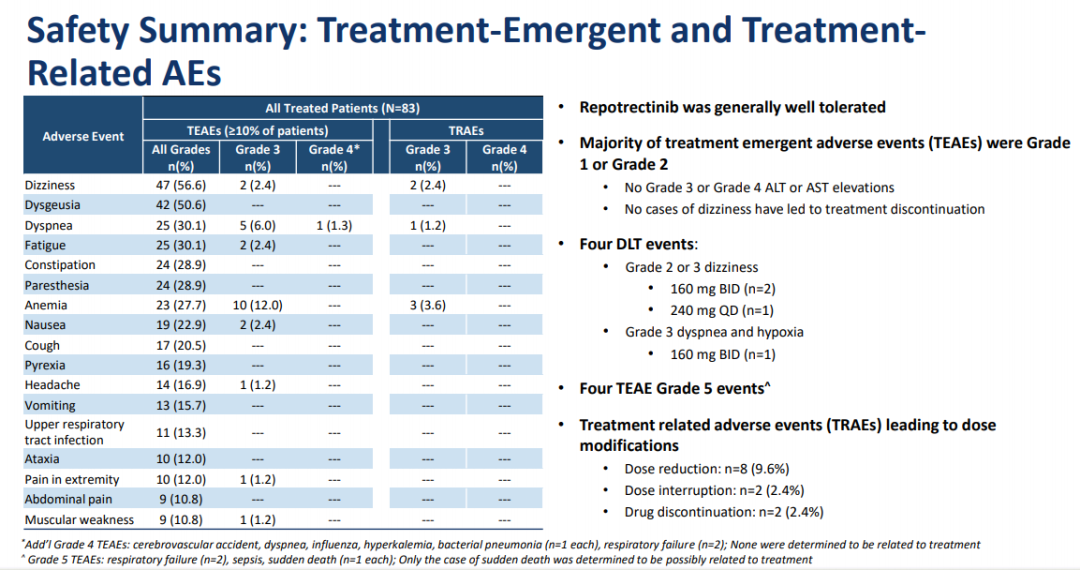
在83例患者队列中评估了安全性( 包括非NSCLC实体瘤,ALK或NTRK重排及ROS1 )。最常见的TRAE是头晕,消化不良,呼吸困难,疲劳,便秘,麻木,贫血和恶心。大多为1级或2级,可控。有4例剂量限制性毒性( 每日两次160mg和每日一次240mg ),以及4例5级TRAEs,包括1例可能与治疗相关的猝死。
目前,针对恩沙替尼(ensartinib)和Alkotinib的临床试验疗效数据尚不充足,敬请期待这两种药物针对ROS1靶向治疗的新进展!
参考文献
1.Shaw AT, Riely GJ, Bang YJ, et al. Crizotinib in ROS1-rearranged advanced non-small-cell lung cancer (NSCLC): updated results, including overall survival, from PROFILE 1001. Ann Oncol. 2019;30(7):1121-1126. doi:10.1093/annonc/mdz131
2.Lim SM, Kim HR, Lee JS, et al. Open-label, multicenter, phase II study of ceritinib in patients with non–small-cell lung cancer harboring ROS1 rearrangement. J Clin Oncol. 2017;35(23):2613-2618. doi:10.1200/jco.2016.71.3701
3.Shaw AT, Solomon BJ, Chiari R, et al. Lorlatinib in advanced ROS1-positive non-small-cell lung cancer: a multicentre, open-label, single-arm, phase 1-2 trial. Lancet Oncol. 2019;20(12):1691-1701. doi:10.1016/s1470-2045(19)30655-2
4.Cho BC, Drilon AE, Doebele RC, et al. Safety and preliminary clinical activity of repotrectinib in patients with advanced ROS1 fusion-positive non-small cell lung cancer (TRIDENT-1 study). J Clin Oncol. 2019;37(suppl 15; abstr 9011). doi:10.1200/JCO.2019.37.15_suppl.9011